【高校化学基礎まとめ】物質
純物質 単一の物質。鉄,酸素,水,エタノールなど
混合物 何種類かの物質が混じり合った物質。
石油 さまざまな有機物が含まれる。
空気 窒素や酸素などが含まれる。
塩酸 水に塩化水素を溶かしたもの。
沸点・融点 純物質は沸点・融点が一定の値に決まっているが,混合物は一定の沸点・融点を示さない。
混合物の分離
分離 混合物から物質を分けて取り出す操作。
精製 不純物を取り除き,より純度の高い物質を得る操作。
ろ過 ろ紙などで固体と液体を分離する操作。ろ紙を通り抜けた液をろ液という。
蒸留 混合物を沸騰させ,生じた蒸気を冷却し,液体を分離する操作。
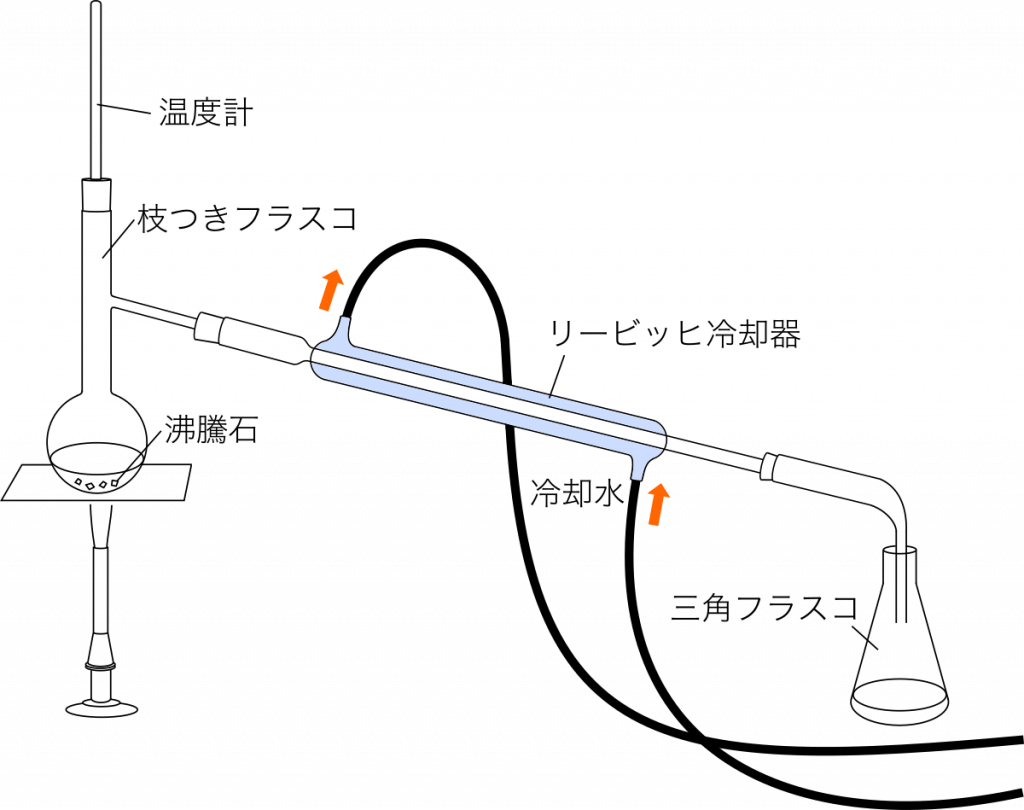
・沸騰石を入れる(突沸を防ぐため)。
・冷却水は下側から上側の向きに流す(気泡を速やかに追い出すため)。
・三角フラスコは密栓をしない(枝付きフラスコ内で気体が発生し,圧力が高くなるため。密栓すると枝付きフラスコが破損することがある)。
分留 沸点の違いを利用して,混合物を各成分に分離する操作。原油からガソリン,灯油,軽油などを分離する。
昇華法 固体が直接気体になる,または気体が直接固体になる変化を昇華という。
・ヨウ素$\text{I}$と塩化ナトリウム$\text{NaCl}$の混合物を加熱すると,ヨウ素だけが昇華し,気体を冷却することで純粋なヨウ素の結晶が得られる。
抽出 混合物に特定の溶媒を加えて,目的の物質だけを分離する操作。分液ろうとを用いる。
再結晶 温度による溶解度の違いを利用して,目的となる物質の結晶を得る操作。
・少量の硫酸銅(II) $\text{CuSO}_4$ が混合した硝酸カリウムを熱水に溶かし,ゆっくりと冷却すると硝酸カリウムのみが結晶として析出する。
硫酸銅(II)の(II)とは?
(II)はイオンの価数を表す。硫酸銅は,硫酸銅(I)$\text{Cu}_2\text{SO}_4$と硫酸銅(II)$\text{CuSO}_4$がある。それぞれイオンに分かれたとき
硫酸銅(I) $\text{Cu}_2\text{SO}_4\longrightarrow2\text{Cu}^++{\text{SO}_4}^{2-}$
硫酸銅(II) $\text{Cu}\text{SO}_4\longrightarrow\text{Cu}^{2+}+{\text{SO}_4}^{2-}$
となる。イオンに分かれたとき,硫酸銅(I)は1価の陽イオンである銅(I)イオン$\text{Cu}^+$になり,硫酸銅(II)は2価の陽イオンである銅(II)イオン$\text{Cu}^{2+}$になる。
このように,銅などのいくつかの原子は異なる価数のイオンを持ち,名前が同じでも化学式が異なるものがある。このとき,それぞれの物質を価数の違いによって(I)や(II)として表している。
ペーパークロマトグラフィー 物質中での移動速度の違いを利用して混合物を各成分に分離する操作。ろ紙を用いたものをペーパークロマトグラフィーという。
元素
元素 物質を構成している基本的な成分。$\text{H}$,$\text{O}$,$\text{Fe}$など
単体 1種類の元素からできている純物質。水素 $\text{H}_2$,ヘリウム$\text{He}$など
化合物 2種類以上の元素からできている純物質。水$\text{H}_2\text{O}$など
単体と化合物
たとえば,牛乳にはカルシウムが含まれる,と言うことがある。しかし,実際には,牛乳に含まれるカルシウムは単体の状態で液体に溶けているのではなく,他の元素と結びついた化合物として存在している。したがって,この場合のカルシウムは単体ではなく,物質に含まれる元素の意味で使われている。
同素体 黒鉛とダイヤモンドはどちらも炭素からできている単体であるが,性質が異なり,これらを同素体という。
・炭素の同位体 黒鉛,ダイヤモンド,フラーレン
・酸素の同位体 酸素$\text{O}_2$,オゾン$\text{O}_3$
・硫黄の同素体 斜方硫黄,単斜硫黄,ゴム状硫黄
・リンの同素体 赤リン(マッチに使われる),黄リン(有毒で自然発火する。水中で保存する。)
炎色反応 ある種の元素を含んだ物質を炎の中に入れると,その元素に特有な色が現れることがある。
覚えるべき炎色反応
リチウム Li (赤) ナトリウム Na (黄) カリウム K (赤紫) 銅 Cu (青緑) カルシウム Ca (橙赤) ストロンチウム Sr (紅) バリウム Ba (黄緑)
沈殿 食塩水に硝酸銀水溶液を加えると,白色の沈殿(塩化銀$\text{AgCl}$が生じる。また,大理石に希塩酸を注ぎ発生した気体(二酸化炭素$\text{CO}_2$)を水酸化カルシウム水溶液(石灰水)に通じると炭酸カルシウム$\text{CaCO}_3$の沈殿を生じる。
物質の三態
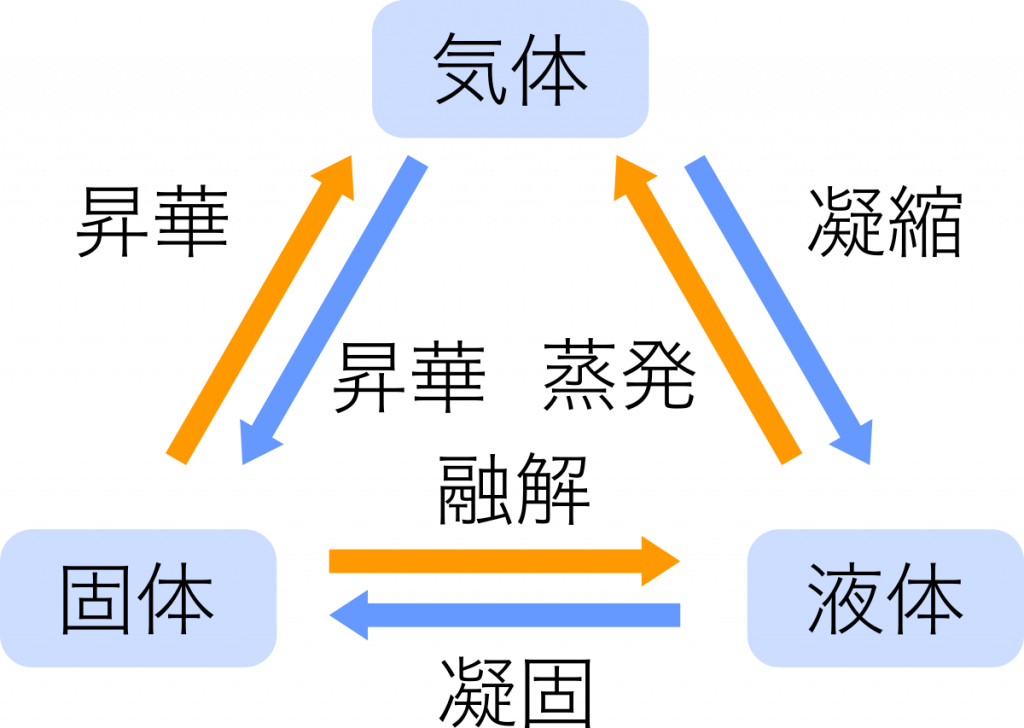
物理変化 物質の状態だけが変わる変化。氷が水になるなど
化学変化(化学反応) 分解や化合によって物質の種類が変わる変化。水を電気分解すると,水素と酸素が発生するなど
拡散 容器に入れた気体が自然に容器全体に均一に広がっていくような現象を拡散という。
熱運動 粒子は常に不規則な運動をしている。これを熱運動という。固体では,粒子間にはたらく力が強く,粒子はごくわずかに振動している。液体では,粒子は粒子間の力により集合しながら動き回っている。気体では,粒子は空間を自由に飛び回っている。物質の熱運動が激しくなるほど,温度が高くなる。
セルシウス温度 水の凝固点を0℃,沸点を100℃として定めた温度。
絶対温度 -273℃を絶対零度を原点として定めた温度。ケルビンKで表す。絶対温度$T$=セルシウス温度$t$+273
SNSでシェア