【高校化学基礎まとめ】イオン
イオン
電解質を水に溶かすと,正の電荷をもつ陽イオンと,負の電荷をもつ陰イオンに分かれる。
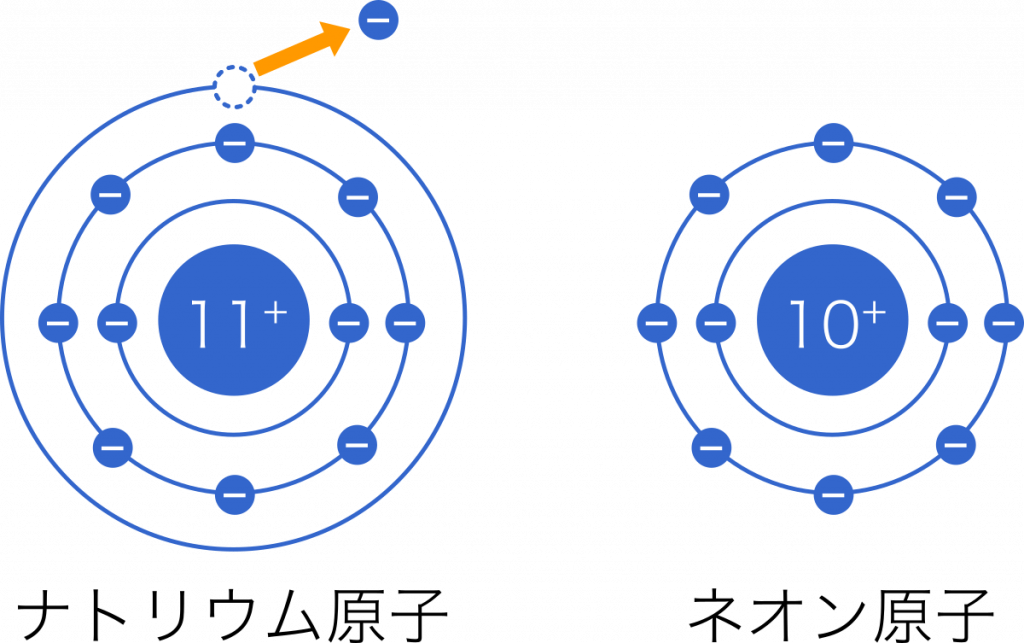
ナトリウム原子Naは価電子を1個失い,1価の陽イオン$\text{Na}^+$になる。このときの電子配置はネオンと同じである。原子は,原子番号がもっとも近い希ガスの原子と同じ電子配列をとる傾向がある。価電子(最外殻電子の数)が1,2,3個の原子は,電子を放出して陽イオンになりやすい。
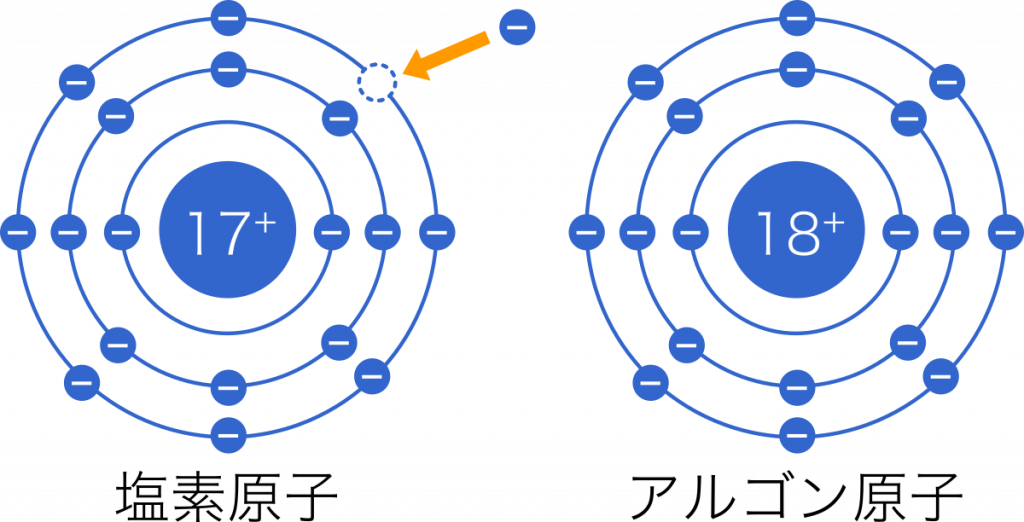
塩素原子Clは価電子を1個受け取り,1価の陰イオン$\text{Cl}^-$になる。このときの電子配置はアルゴンと同じである。価電子が6,7個の電子は,電子を受け取って陰イオンになりやすい。
分子式とイオン式
$\text{Cl}_2$のように,プラスマイナスの符号が付かないものが分子式。$\text{Na}^+$や$\text{Cl}^-$のようにプラスマイナスの符号が付いたものがイオン式。
イオン式
1価の陽イオン
水素イオン $\text{H}^+$
ナトリウムイオン $\text{Na}^+$
リチウムイオン $\text{Li}^+$
カリウムイオン $\text{K}^+$
銀イオン $\text{Ag}^+$
銅(I)イオン $\text{Cu}^+$
アンモニウムイオン ${\text{NH}_4}^+$
オキソニウムイオン $\text{H}_3\text{O}^+$
2価の陽イオン
マグネシウムイオン $\text{Mg}^{2+}$
カルシウムイオン $\text{Ca}^{2+}$
バリウムイオン $\text{Ba}^{2+}$
鉄(II)イオン $\text{Fe}^{2+}$
銅(II)イオン $\text{Cu}^{2+}$
3価の陽イオン
アルミニウムイオン $\text{Al}^{3+}$
鉄(III)イオン $\text{Fe}^{3+}$
1価の陰イオン
塩化物イオン $\text{Cl}^-$
フッ化物イオン $\text{F}^-$
臭化物イオン $\text{Br}^-$
ヨウ化物イオン $\text{I}^-$
水酸化物イオン $\text{OH}^-$
硝酸イオン ${\text{NO}_3}^-$
酢酸イオン $\text{CH}_3\text{COO}^-$
炭酸水素イオン ${\text{HCO}_3}^-$
硫酸水素イオン ${\text{HSO}_4}^-$
リン酸二水素イオン ${\text{H}_2\text{PO}_4}^-$
2価の陰イオン
酸化物イオン $\text{O}^{2-}$
硫化物イオン $\text{S}^{2-}$
硫酸イオン ${\text{SO}_4}^{2-}$
炭酸イオン ${\text{CO}_3}^{2-}$
リン酸水素イオン ${\text{HPO}_4}^{2-}$
3価の陰イオン
リン酸イオン ${\text{PO}_4}^{3-}$
水素イオンのように1個の原子からなるイオンを単原子イオン,水酸化物イオンのように2個以上の原子からなる原子団のイオンを多原子イオンという。
イオン化エネルギーと電子親和力
原子が電子1個を取り去り,1価の陽イオンになるとき,原子はエネルギーを受け取る。このエネルギーをイオン化エネルギーという。一般に,イオン化エネルギーが小さい原子ほど陽イオンになりやすい。アルカリ金属の原子はイオン化エネルギーが小さく,希ガスの原子はイオン化エネルギーが大きい。
また,原子が電子1個を受け取って1価の陰イオンになるとき,エネルギーが放出される。このエネルギーを電子親和力という。一般に,電子親和力が大きい原子ほど陰イオンになりやすい。ハロゲンの原子は電子親和力が大きい。
イオン半径の性質
イオン半径 イオンを球形とみなしたときの球の半径。
陽イオンの場合 最外殻電子が放出されるので,イオン半径は小さくなる。
陰イオンの場合 最外殻に電子が入ると,電子どうしの反発力が強くなり,その距離が大きくなる(正の電荷をもつ陽子の数は変化しないので,陽子が電子を引き付ける力の大きさは変わらないことに注意する)。よって,イオン半径は大きくなる。
同じ原子配置の場合 ナトリウムイオン(原子番号11) $\text{Na}^+$ とネオン(原子番号10) $\text{Ne}$ は同じ電子配置を持つが,ナトリウムイオンの方が陽子の数が多く,電子を引き付ける力が強いため,イオン半径は小さくなる。
同族元素の場合 原子番号が大きくなるにつれ,電子がより外側の電子殻に配置されるので,イオン半径は大きくなる。
イオン結合
イオン結合 陽イオンと陰イオンに静電気的な引力(クーロン力)による結合をイオン結合という。また,陽イオンと陰イオンがイオン結合によって規則正しく配列した結晶をイオン結晶という。
化学式と組成式
例えば,酸素 $\text{O}_2$ は独立した分子として空気中に存在している。このとき,$\text{O}_2$ は化学式である。一方で塩化ナトリウム $\text{NaCl}$ は多数の塩化ナトリウムが結びついた結晶として存在している。このとき,結合しているナトリウム $Na$ と塩素 $Cl$ の数をすべて数えるのではなく,それぞれの元素をもっとも簡単な整数の比で表す。これを組成式という。同様に,鉄を $\text{Fe}$ と表すように,金属結晶も組成式として表す。
主なイオン結晶
塩化ナトリウム $\text{NaCl}$ 食塩の主成分。
塩化カルシウム $\text{CaCl}_2$ 除湿剤,道路の凍結防止剤。
炭酸水素ナトリウム $\text{NaHCO}_3$ 重曹とも呼ばれる。ベーキングパウダー,発砲入浴剤など。
水酸化ナトリウム $text{NaOH}$ 苛性ソーダとも呼ばれる。セッケンなどの原料。
硫酸カルシウム $\text{CaSO}_4$ 石膏とも呼ばれる。彫刻や建築材料など。
炭酸カルシウム $\text{CaCO}_3$ 石灰石や貝殻の主成分。チョークなど。
水酸化カルシウム $\text{Ca}(\text{OH})_2$ 消石灰とも呼ばれる。水溶液は石灰水。しっくいの原料。さらし粉の原料。
硫酸アンモニウム $(\text{NH}_4)_2\text{SO}_4$ 窒素肥料。
SNSでシェア